
印尼医疗器械备案指南:流程、注意事项及专业指南
发布时间:2小时前
阅读量:4
印尼医疗器械备案指南
一、引言
随着中国与印尼在医疗领域的合作日益加深,越来越多的医疗器械进入印尼市场。为了确保医疗器械的安全性和有效性,印尼政府实施了一系列的备案和监管措施。本文将为您详细介绍印尼医疗器械备案的相关流程和注意事项。
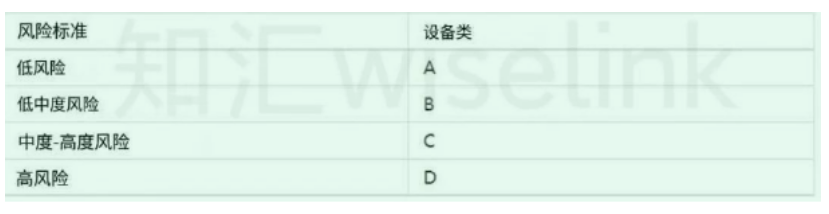
二、备案流程
- 了解法规:首先,需要了解印尼关于医疗器械的法律法规,包括《印尼医疗器械管理法》等。
- 准备资料:根据法规要求,准备相关的技术文件,如产品说明书、技术规格、质量检测报告等。
- 提交申请:将资料提交给印尼食品药品监督管理局(BPOM)进行备案申请。
- 审核:BPOM将对提交的资料进行审核,可能包括现场检查或抽样检测。
- 颁发证书:审核通过后,将颁发医疗器械备案证书。
三、注意事项
- 翻译准确:所有提交的资料需要翻译成印尼语,确保翻译的准确性和专业性。
- 资料完整:提交的资料必须完整,符合法规要求,否则可能导致审核不通过。
- 符合标准:确保产品符合印尼的医疗器械标准和规范。
- 更新信息:如果产品有任何更新或变更,需要及时向BPOM报告并更新备案信息。
- 咨询专业机构:对于复杂的备案流程,建议咨询专业的法律或咨询公司,以确保备案的顺利进行。
四、总结
印尼医疗器械备案是一个必要的步骤,对于进入印尼市场的医疗器械产品而言,遵守相关的法规和流程是非常重要的。通过本文的介绍,希望能够帮助您更好地了解印尼医疗器械备案的相关知识和注意事项,为您的产品顺利进入印尼市场提供帮助。
 高速稳定云服务器9.9元起
高速稳定云服务器9.9元起





































