
二类医疗器械销售备案全流程解析:从申请到审核完成

二类医疗器械销售备案审核流程
本文将详细介绍二类医疗器械销售备案审核流程,帮助相关企业和个人了解备案审核的相关要求和步骤,以便顺利完成备案手续。
一、了解相关法规要求
在开始备案审核流程之前,首先需要了解国家关于二类医疗器械销售的相关法规要求。这些法规对于医疗器械的销售、使用和管理都有明确的规定,确保产品的安全性和有效性。

二、准备备案材料
根据法规要求,准备相应的备案材料。这些材料包括但不限于:企业营业执照、税务登记证、医疗器械注册证、产品检验报告等。确保所有材料齐全、准确。

三、在线提交备案申请
登录相关网站,在线提交备案申请。填写申请表格时,应如实填写企业信息、产品信息和销售情况等。上传备案材料时,确保文件格式正确、清晰可辨。
四、等待行政部门的初步审核
提交申请后,等待行政部门的初步审核。行政部门会对提交的材料进行审查,确认是否符合法规要求。如材料不全或不符合要求,行政部门会通知补充或修改。
五、现场检查与产品检验
初步审核通过后,行政部门会组织现场检查和产品检验。现场检查主要是对销售场所、仓储设施等进行实地查看,确保符合法规要求。产品检验则是对医疗器械的安全性、有效性等进行检测。
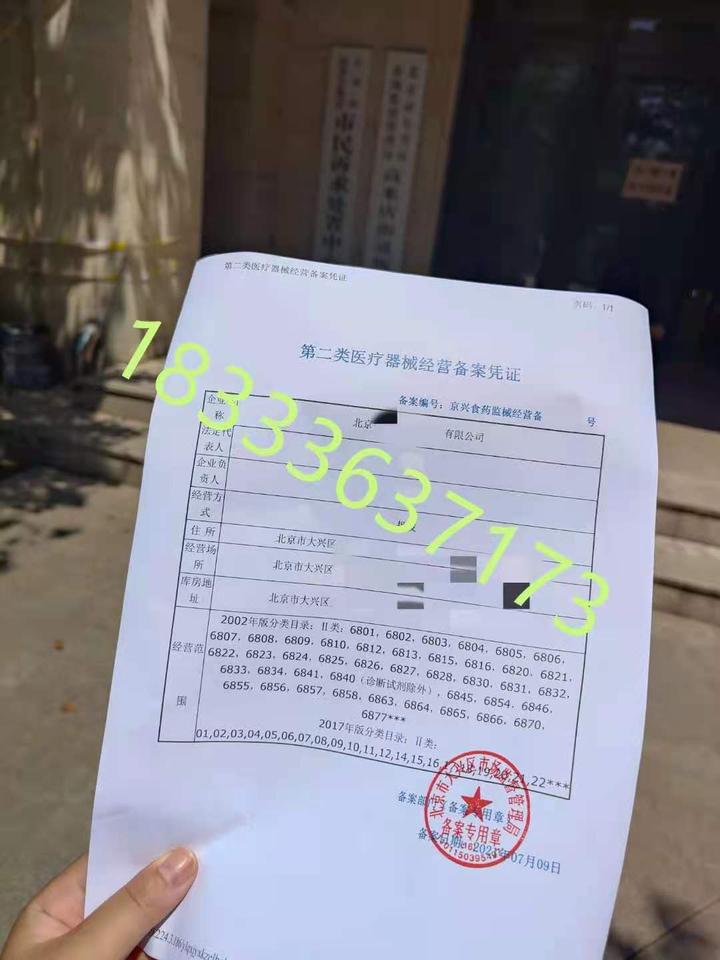
六、领取备案证书
经过现场检查和产品检验后,如一切正常,行政部门会颁发备案证书。备案证书是销售二类医疗器械的合法凭证,企业需妥善保管。
七、定期更新与续期
备案证书有一定的有效期,到期前需按照相关流程进行更新或续期。确保备案信息的准确性和有效性。
总结:了解二类医疗器械销售备案审核流程,有助于企业和个人顺利完成备案手续,合法销售医疗器械。在备案过程中,需严格遵守法规要求,确保产品的安全性和有效性。
高速稳定云服务器9.9元起





































