
福田地区二类医疗器械备案要求详解:从流程到要点全解析
发布时间:1 天前
阅读量:2

福田二类医疗器械备案要求
一、引言
医疗器械是医疗领域不可或缺的重要设备,对于保障人民健康具有至关重要的作用。为了规范医疗器械的管理,国家对医疗器械的生产、经营和使用都进行了严格的规定。本文将详细介绍福田地区二类医疗器械备案的相关要求。
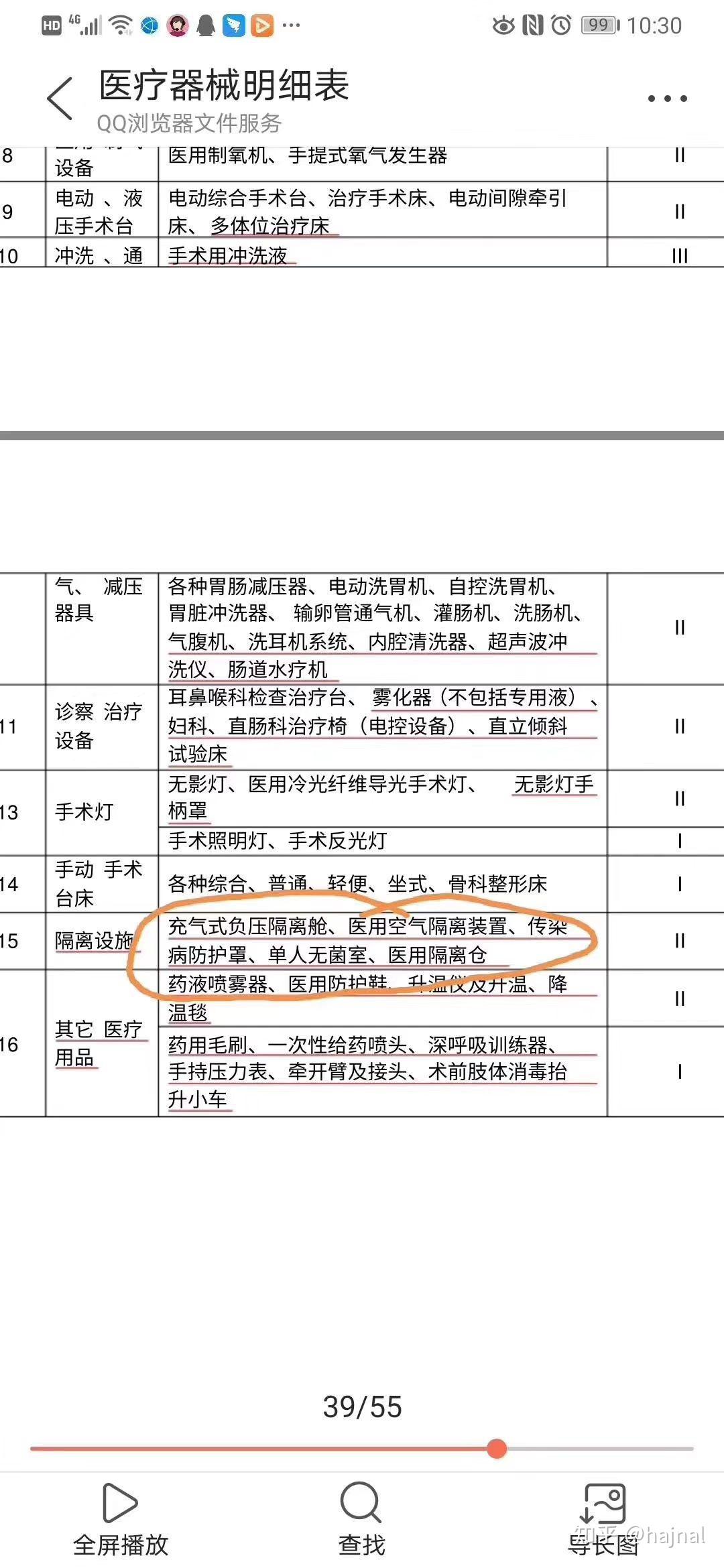
二、备案主体及范围

福田地区的医疗机构、生产企业以及其他涉及医疗器械使用的单位,在使用二类医疗器械前,均需按照相关规定进行备案。备案范围包括各类诊断设备、治疗设备、辅助设备以及体外诊断试剂等。
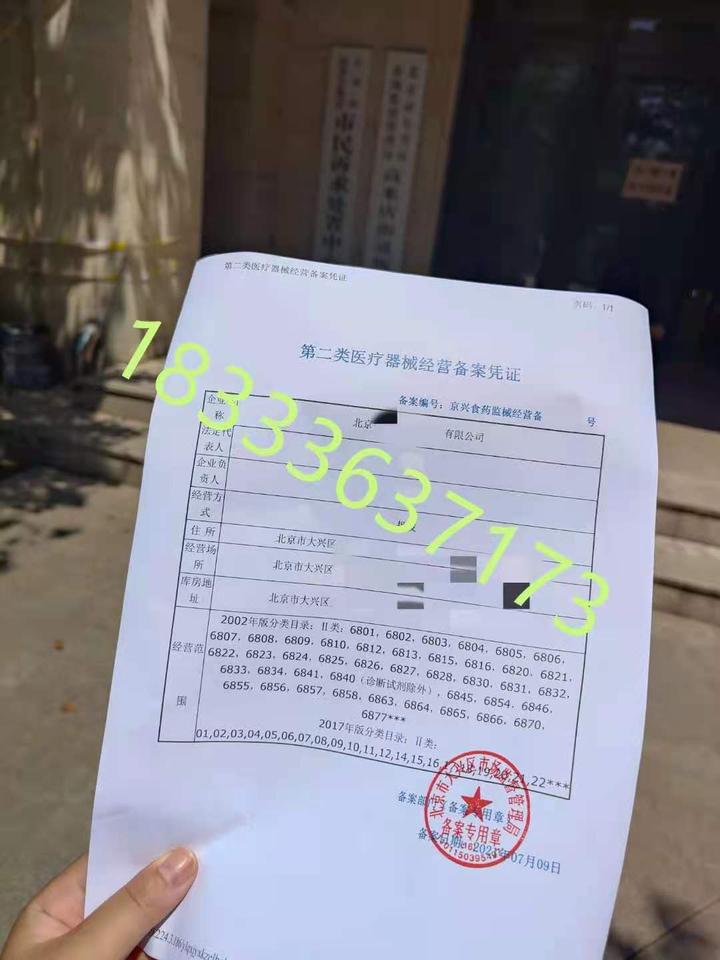
三、备案流程
备案流程主要包括以下几个步骤:
- 准备相关材料:包括产品技术报告、质量检测报告、产品注册证书等。
- 在福田食品药品监督管理局进行备案登记。
- 提交材料并填写相关表格。
- 等待审核,审核通过后领取备案证书。
四、备案要求
- 提交的材料必须真实、准确、完整。
- 备案产品的质量标准必须符合国家标准和行业标准。
- 备案单位需具备相应的生产、经营资质。
- 备案后,产品如有变更,需及时重新备案。
五、注意事项
- 备案前需详细了解相关法规和政策,确保备案的顺利进行。
- 备案过程中如遇到问题,应及时向相关部门咨询。
- 备案后需严格按照规定使用和管理医疗器械。
六、总结
福田地区对二类医疗器械的备案要求十分严格,各单位在使用前需充分了解并遵守相关规定。通过规范的备案流程,可以确保医疗器械的安全、有效,保障人民的健康。
高速稳定云服务器9.9元起

































