
每月特惠专区,精选多地区云服务器产品,配置灵活,适合短期测试及常规业务部署。









































携手合作伙伴,实现业务上的双向合作共赢
我们为您提供全方位的支持与服务,确保您在使用我们的云服务时无忧无虑。
10+年商誉沉淀,深耕中国香港及海外高端资源

随着干细胞技术的不断发展,干细胞临床研究逐渐成为医学领域的重要研究方向。广东省作为我国重要的医学研究中心,对干细胞临床研究的管理和备案要求十分严格。本文旨在介绍广东省干细胞临床研究备案的相关要求。
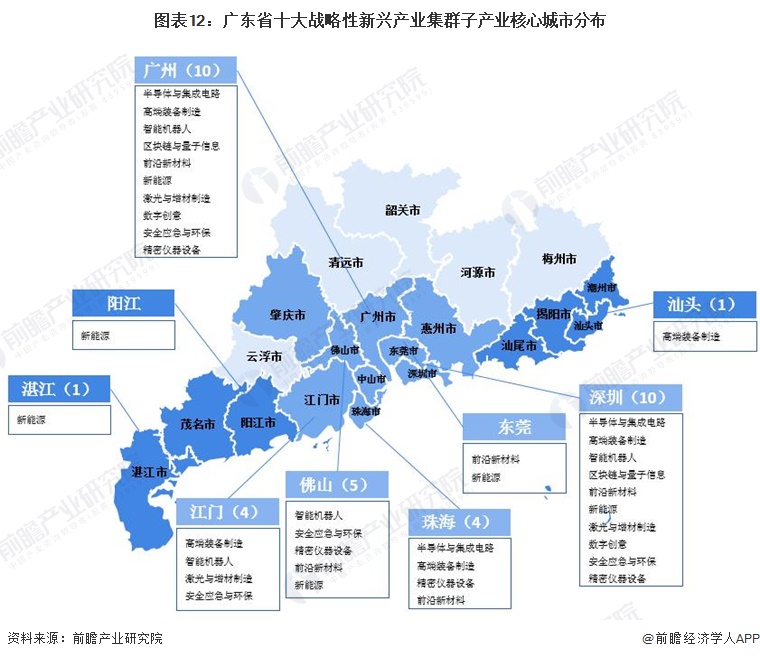
广东省干细胞临床研究备案要求是为了保障干细胞临床研究的科学性和安全性,促进干细胞技术的健康发展。相关机构和团队应严格遵守备案要求,确保研究过程合法合规,为干细胞技术的临床应用提供有力支持。
 高速稳定云服务器9.9元起
高速稳定云服务器9.9元起


