"二类医疗器械备案与一类:关键差异解析"
其他信息
2025-03-11 03:48
271
二类医疗器械备案与一类医疗器械备案的区别
医疗器械关乎民众的健康与生命质量,是国家实施严格监管的产品类别之一。在我国医疗器械管理中,依据风险程度和用途,医疗器械分为一类、二类和三类。而备案制度的实施是针对不同类别的医疗器械的管理措施。接下来我们详细介绍一类和二类医疗器械备案之间的区别。
一、定义区别
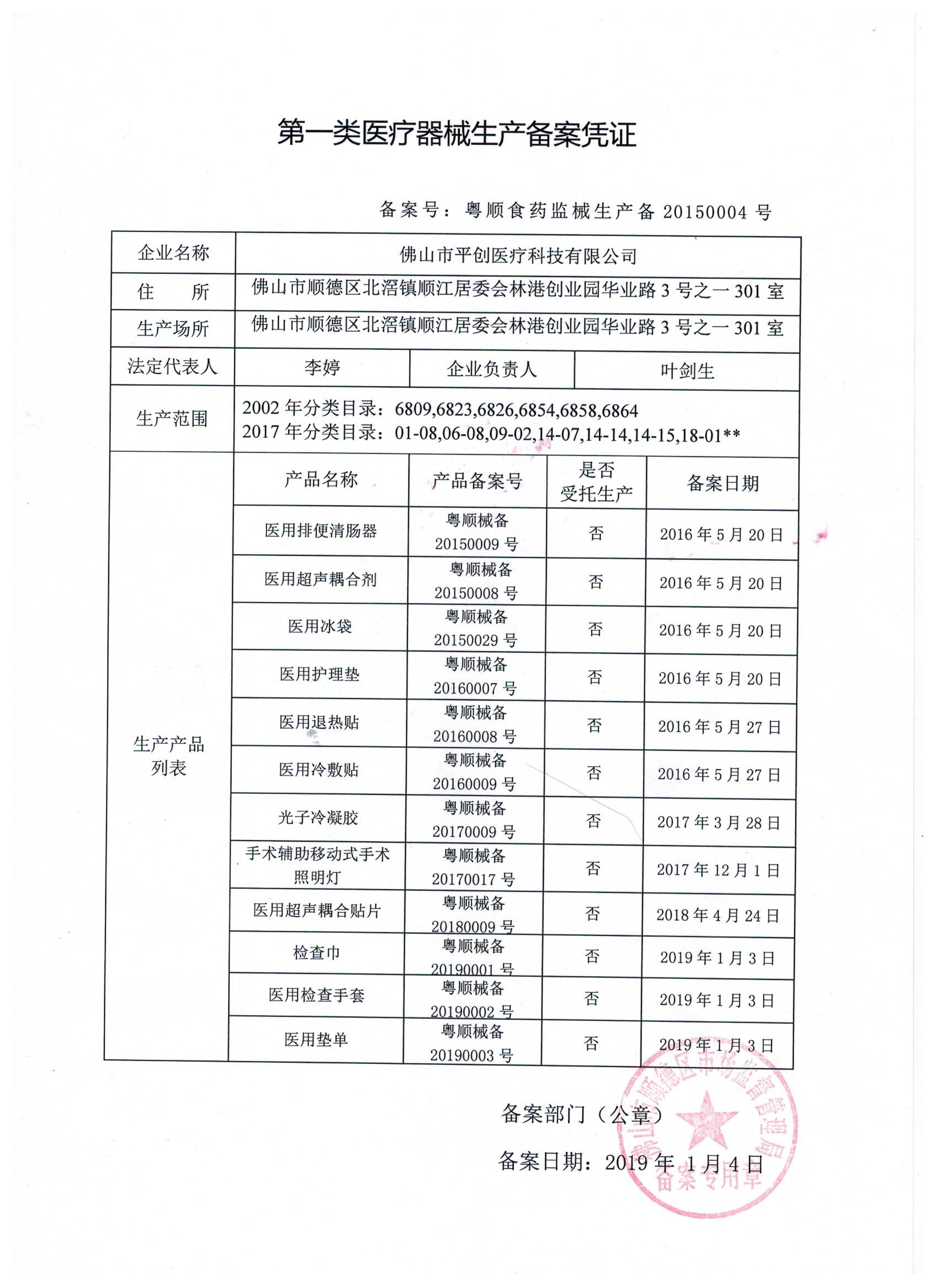
一类医疗器械通常指的是那些通过常规管理足以保证其安全性的医疗器械,例如医用冷敷贴等。这类器械的风险程度较低,一般只需进行常规管理即可。而二类医疗器械则是指具有一定风险程度,需要特殊管理的器械,如血压计、额温枪等。其管理需要更严格的审核和监督措施。

二、备案要求区别
一类医疗器械备案相对来说要求较为简单,只需按照规定流程向当地食品药品监督管理部门提交相关材料备案即可。而二类医疗器械备案则需要更加详细的审核流程,包括提交产品的技术报告、安全风险评估报告等文件,并且需要经过现场审核等环节。此外,二类器械备案涉及到的产品范围更广,审核标准更为严格。
三、监管措施区别
在监管措施上,一类医疗器械相对来说管理较为宽松,主要采取事后监管的方式。而二类医疗器械则需要事前进行审批和监管,确保产品的安全性和有效性。同时,对于已经上市的二类医疗器械,监管部门还会进行定期的监督检查和抽检工作,确保其持续符合质量要求。
总结来说,一类和二类医疗器械备案在定义、备案要求以及监管措施等方面均存在明显差异。随着国家对医疗器械监管力度的不断加强,两类医疗器械备案的区分也将更加明确和严格。无论是生产企业还是使用单位,都应严格遵守相关法规,确保产品的质量和安全。
標籤:
- 关键词:二类医疗器械备案
- 一类医疗器械备案
- 定义区别
- 备案要求区别
- 监管措施区别

