“一类和二类医疗产品备案要求解析:了解备案流程及重要性”
其他信息
2025-04-27 02:40
203
一类二类医疗产品是否需要备案
随着医疗技术的不断发展和医疗行业的迅速壮大,医疗产品的管理和监管问题日益受到人们的关注。其中,一类和二类医疗产品是否需要备案,成为了广大从业者关心的热点问题。以下是对这个问题的详细解答。
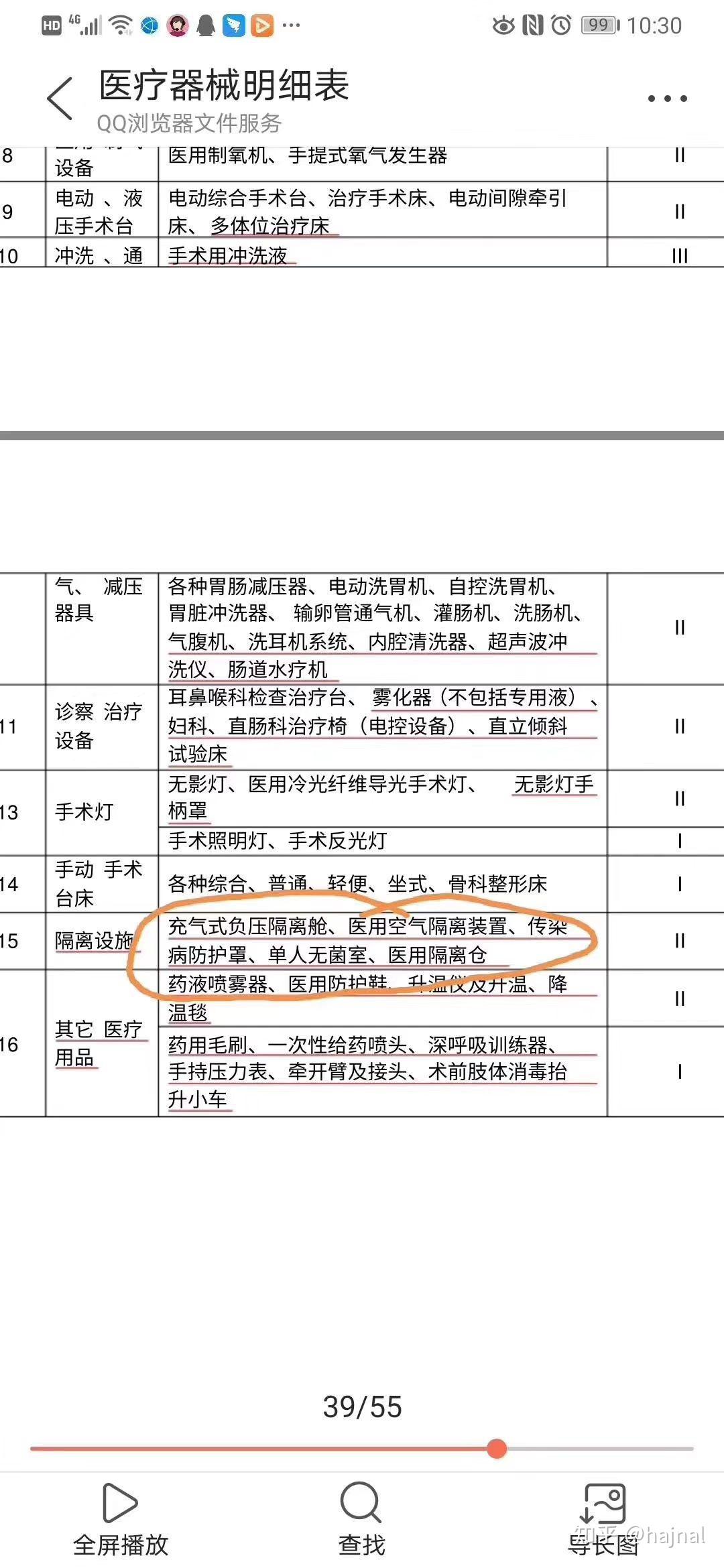
一、关于医疗产品的分类
在中国,医疗产品根据监管要求和风险等级,一般分为一类、二类和三类。其中,一类医疗产品风险较低,通常是常规的基础医疗设备;二类医疗产品风险稍高,涉及到人体某些重要部位或功能的医疗设备;三类医疗产品则属于高风险医疗设备。对于不同类型的产品,国家会制定相应的监管政策和标准。
二、一类和二类医疗产品是否需要备案
对于一类和二类医疗产品,根据现行法规,确实需要进行备案。备案是为了确保产品的安全性、有效性和质量可控性,保护患者和消费者的权益。备案过程中,企业需提交产品的技术资料、生产工艺、质量控制等相关文件,经过监管部门的审核和评估后,获得备案证书方可上市销售。

三、备案的重要性
备案不仅是法律要求,更是企业诚信和产品质量的重要保障。通过备案,企业可以建立起良好的市场信誉,提高消费者的信任度。同时,备案过程中监管部门的专业指导,也能帮助企业规范生产流程,提高产品质量。
四、总结
综上所述,一类和二类医疗产品是需要备案的。企业应按照相关法律法规的要求,完成产品的备案工作,确保产品的合法上市,为消费者提供安全、有效的医疗设备。同时,企业也应在生产过程中不断总结经验,优化产品性能和质量,为社会提供更好的医疗服务。
标签:
- 关键词:医疗产品分类
- 一类医疗产品
- 二类医疗产品
- 备案
- 产品质量安全

